Stål er vor tids mest anvendte materiale. Desværre har stål en stor ulempe og det er dets høje korrosionshastighed. At beskytte materialer og konstruktioner af stål er derfor af stor værdi.
Den bedste korrosionsbeskyttelse opnås med zink. Zinkbelægningen på stål beskytter mod korrosion på to måder:
- Som barriere, dvs. forhindrer oxygen og fugt i at trænge ind til ståloverfladen
- Ved at give katodisk beskyttelse i ridser, slagmærker, klippekanter osv.
Zink er et uædelt metal med stor korrosionstilbøjelighed. At korrosionshastigheden trods alt er lav i de fleste miljøer skyldes, at metallets overflade hurtigt bliver dækket af korrosionsprodukter, som yder beskyttelse mod videre korrosion.
Korrosion i atmosfæren
Når en varmforzinket konstruktion tages op af zinkbadet, angribes overfladen omgående af luftens ilt og danner zinkoxid. Luftens indhold af vand og kuldioxid ændrer hurtigt laget til basiske zinkkarbonater. Men luften indeholder også svovldioxider, som omdanner det basiske zinkkarbonat til mere letopløseligt zinksulfit og zinksulfat. Luftens indhold af svovldioxid er dog mindsket kraftigt de seneste år, og dermed også zinkens korrosionshastighed.
Atmosfærens indhold af svovldioxid påvirker således korrosionshastigheden, og derfor er korrosionen højere i industriatmosfære end i by- og landsbymiljø. Eksponeringsvinklen er af betydning i alle miljøer. Korrosionen er højere på en horisontal overflade end på en vertikal. Overflader, der befinder sig i læ, korroderer mindre end ubeskyttede overflader.
Zinklag, som eksponeres nogle måneder i atmosfæren, får en mat, lysegrå kulør (billede 1).
I havmiljø påvirkes zinkens korrosion af luftens saltindhold. I havluft findes små mængder af magnesiumsalte med en god passiverende virkning, og korrosionen er derfor ikke så stor, som man kunne forestille sig. Saltindholdet aftager jo længere man kommer ind i landet.
Zinkens korrosion påvirkes altså af mange faktorer. En universel formel for korrosionshastighed kan man ikke opstille. Mange års erfaring og et utal af langtidsforsøg med zink som rustbeskyttelse, har givet et godt kendskab til zinkens korrosion og korrosionshastighed i forskellige miljøer. Vi har i dag eksempler på zinkbelægninger, som er eksponeret i over hundrede år.

Billede 1. Eksponeret overflade af en zinkbelægning med et ydre lag af ren zink. Den blanke overflade er erstattet af et gråt korrosionsprodukt, sommetider kaldet zinkpatina.

Billede 2. Siliciumberoligede stål, som har en stor andel jernzink-fase i zinklaget, kan efter en tids eksponering få en rødbrun farve, som med tiden bliver mørkere. Når jernzink-legeringen korroderer, frigøres der jern, der sammen med luftens fugtighed eller regn danner rust. Rusten kan, selv ved små mængder, give en kraftig misfarvning. Er misfarvningen meget kraftig, kan man få det indtryk, at rustbeskyttelsen er meget nedsat eller ophørt. Dette er dog sjældent tilfældet. Jernzink-legeringen beskytter det underliggende stål bedre mod korrosion.
Korrosion i væsker
Når en forzinket konstruktion nedsænkes i en væske, dannes der, som ved eksponering i luft, et beskyttende lag af korrosionsprodukter. Væske kan være sur eller alkalisk og indeholde løse eller faste aggressive emner. Væskens strømningshastighed og temperatur har også betydning. Tilsammen kan disse faktorer medføre, at beskyttelseslaget får en meget varieret sammensætning eller at det ikke dannes overhovedet.
Den elektrokemiske korrosion, som i luft spiller en underordnet rolle, har stor betydning i væsker, og sker over et større eller mindre område, afhængig af væskens ledningsevne og zinklagets beskyttende virkning.
Størst betydning har væskens pH-værdi. Zinkens korrosionshastighed er normalt relativ lav og stabil i pH-området 5,5-12,5 (evt. grafisk visning) og ved temperaturer mellem 0 °C og 20 °C. Hårdt vand, som indeholder kalk og magnesium, er ikke særlig aggressivt. Stofferne danner sammen med kulsyre svært opløselige karbonater på zinkoverfladen og giver et stabilt beskyttelseslag, der forhindrer yderligere korrosion.
Blødt vand angriber ofte zink, idet beskyttelseslaget ikke dannes på grund af manglende salte. I sjældne tilfælde kan der også ske en polaritetsbytning mellem zink og stål, så stålet bliver anode (opløsningspol) i elementet med risiko for punktkorrosion. Polaritetsbytning modvirkes af kulsyre, sulfater og klorider og sker derfor ikke i f.eks. havvand, men kan derimod forekomme i meget rent vand (f.eks. kondensvand).Aggressivt blødt vand findes i visse floder og søer i Finland, Norge og Sverige.
Ved strømningshastigheder over 0,5 m/s forhindres dannelsen af beskyttelseslaget på zinkoverfladen, og korrosionen bliver hurtigere.
I vand har temperaturen stor betydning for korrosionshastigheden. Ved mere end 55 °C får korrosionsprodukterne en grovkornet struktur på overfladen og mister vedhæftningen til zinkoverfladen. De falder let af og blotlægger ny, frisk zink, som igen angribes meget hurtigt.
Korrosionshastigheden opnår et maksimum ved ca. 70 °C for senere at synke, så den ved 100 °C er af samme størrelsesorden som ved 50 °C.
Som det fremgår, er korrosionsforløbet i vand meget komplekst og universelle regler er svære at give. Billede 3 angiver praktiske erfaringer og retningsværdier for forskellige vandtyper. For yderligere information se referencer.
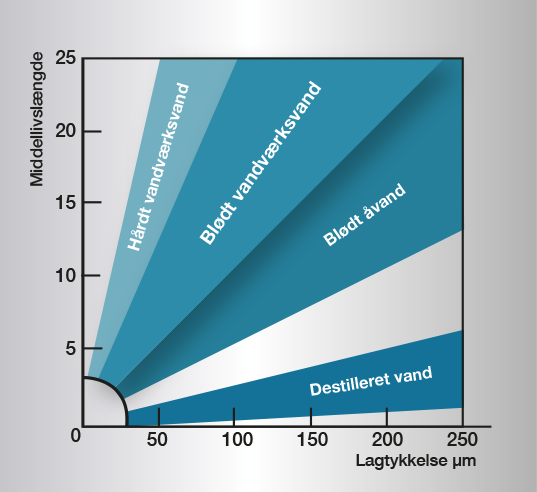
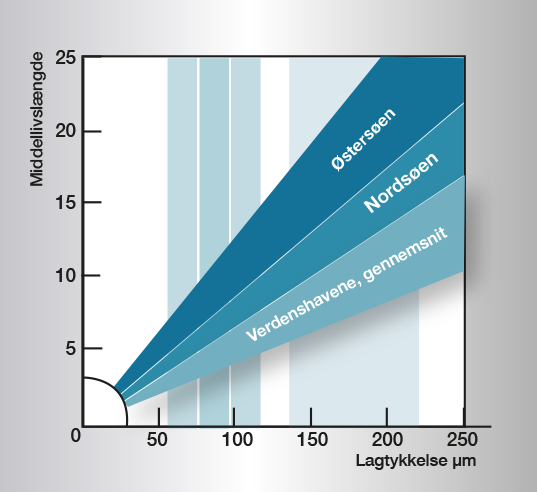
Billede 3. Forholdet mellem zinklagets tykkelse og belægningens middellivslængde i forskellige typer vand.
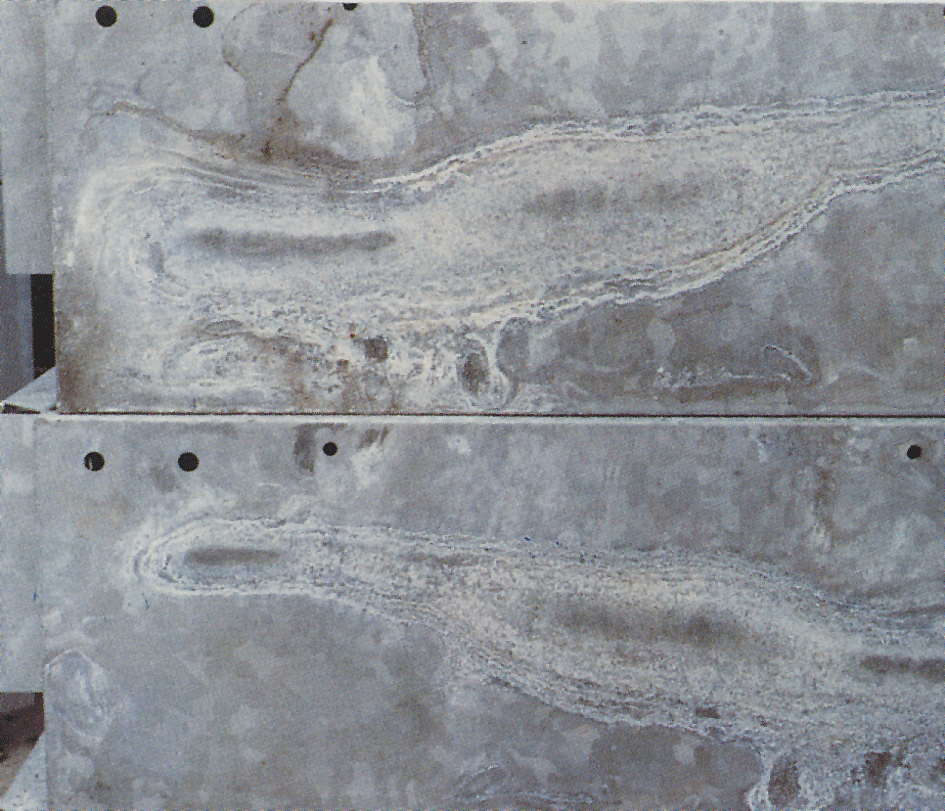
Hvidrust
Til tider opstår en hvid, melet og voluminøs belægning kaldet hvidrust på den forzinkede overflade (billede 4). Belægningen kan opstå på nyforzinkede blanke overflader, som ligger tæt sammen og udsættes for kondens eller regnvand, uden mulighed for efterfølgende hurtig tørring.
Dette kan forekomme, når spalter dannes, f.eks. mellem konstruktionsflader eller mellem tætpakkede plader.
Materialeoverflader, som har god luftgennemstrømning og har opbygget et normalt beskyttelseslag af korrosionsprodukter, angribes sjældent. Angrebet stopper, når der er fri luftgennemgang. Tilbageværende hvidrust slides langsomt væk af vind og vejr. Zinkoverfladen får atter et normalt varmforzinket udseende.
Da hvidrust har en meget stor volumen, ca. 500 gange større end den renzink, den dannes af, kan et angreb forekomme alvorligt. Ofte har angrebet imidlertid kun lille eller ingen betydning for korrosionsbeskyttelsens levetid. På meget tynde belægninger, som f.eks. el-forzinkede emner, kan et kraftigt angreb dog være alvorligt.
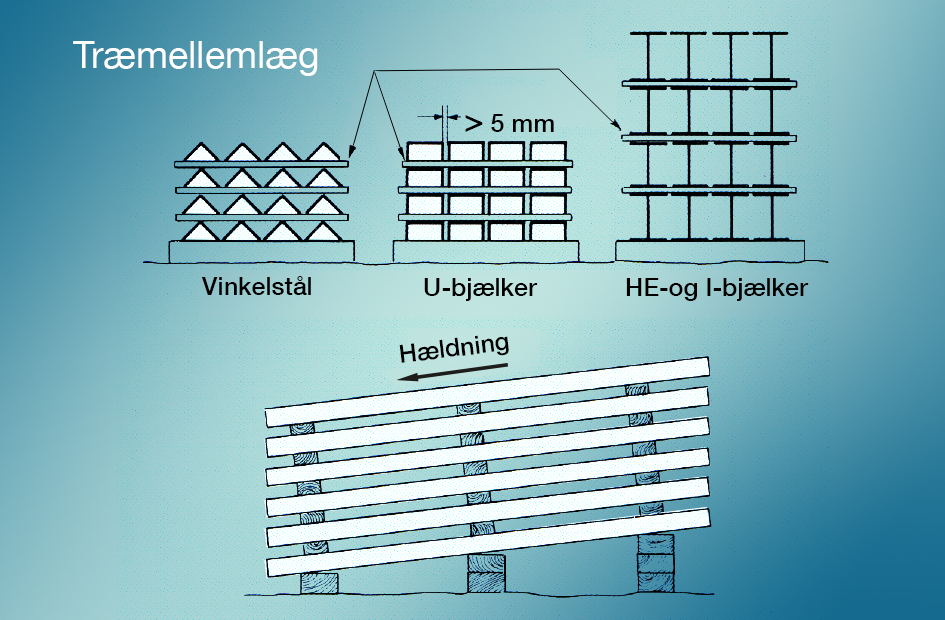
Hvidrust undgås bedst, hvis de forzinkede flader ved lagring og transport forhindres i at komme i kontakt med regn- eller kondensvand. Materialer, der opbevares udendørs, bør lægges, så vandet frit kan løbe af, og lufttilgangen er fri til alle flader (billede 10-5).
Hvidrust kan, helt eller delvist, fjernes ved forsigtig mekanisk eller kemisk behandling. Varmforzinkningsstandarden DS/EN ISO 1461 godtager ikke hvidrust som kassationsgrundlag.
Korrosion i jord
Korrosionsforholdene i jord er meget komplicerede, og variationerne kan være meget store indenfor små afstande. Den danske jord er i almindelighed ikke særlig aggressiv, men der er store variationer, hvorfor man må vurdere forholdene fra sted til sted, baseret på lokale jordbundsforhold (billede 6). Middelkorrosionen for zink plejer at være 5 mikrometer pr år.

Galvanisk korrosion

Hvis to forskellige metaller eller legeringer, som helt eller delvist er omgivet af en elektrolyt, kobles sammen, opstår der en galvanisk celle. Hvilket af metallerne, der bliver anode eller katode, bestemmes af deres elektro depotentiale i elektrolytten. I havvand, som modsvarer de fleste praktiske forhold, indtager et udpluk af forskellige metaller og legeringer pladserne i spændingsrækken, som angivet ved billede 7.
Hvis stål kobles sammen med kobber eller messing, bliver stålet anode i elementet og korroderer. Kobles stål derimod sammen med cadmium, aluminium, zink eller magnesium, bliver stålet katode i elementet og beskyttes, mens anodemetallet forbruges. Galvanisk korrosion kaldes også bimetalkorrosion og anvendes til at beskytte konstruktioner i vand mod korrosion under benævnelsen katodisk beskyttelse.
Zinkbelægningens katodiske beskyttelse
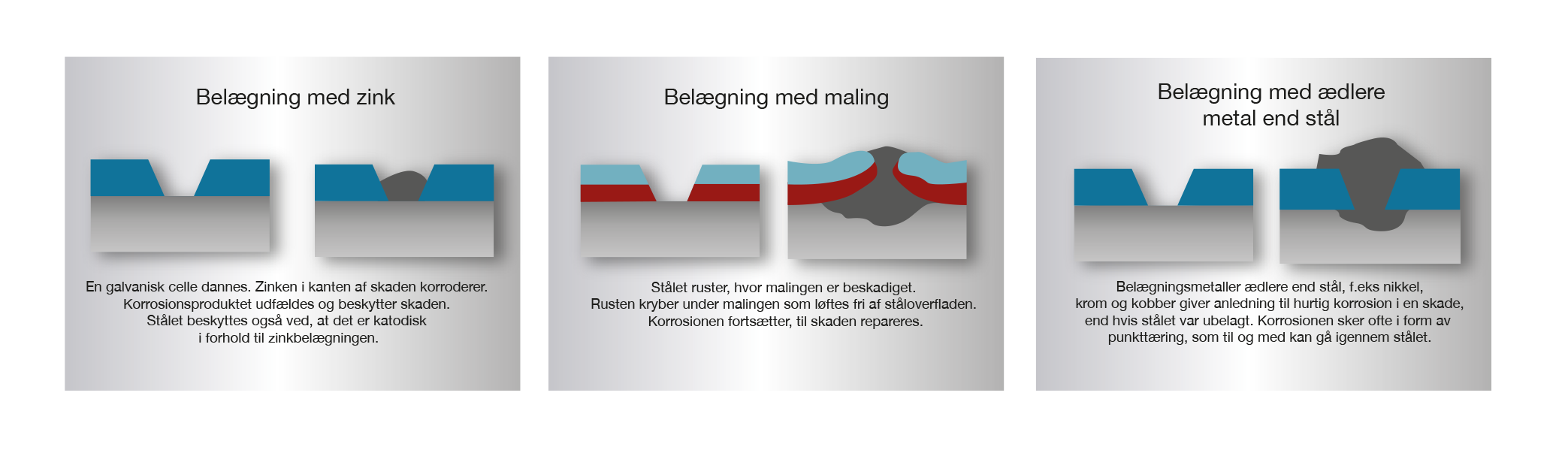
I varmforzinket stål står zink og stål i god elektrisk kontakt med hinanden. Skades zinkbelægningen, opstår der, hvis der er en elektrolyt til stede, en galvanisk celle. I cellen bliver zinken anode (opløsningspol) og korroderer. Det frilagte stål bliver katode og beskyttes mod korrosion.
I begyndelsesfasen kan man ofte se en svag rustdannelse på den frilagte ståloverflade. Zinkbelægningen korroderer og svært opløselige zinkforbindelser udfældes på overfladen og beskytter stålet mod fortsat angreb. Dette omtales ofte som ”at zinken er selvhelende”, hvilket dog ikke er korrekt, da zinklaget ikke gendannes. Takket være den katodiske beskyttelse, som zinken genererer, sker der ingen underrust af zinkbelægninger, som det kendes under malinger eller belægninger af ædlere metaller (billede 8).
I vand og nedgravet i jord skal der altid anvendes fraisolering, da der ikke må være metallisk kontakt mellem zink og de mere ædle metaller, hvis man skal undgå galvanisk korrosion på zink. Der må heller ikke være indirekte metallisk kontakt via andre konstruktionsdele.
I vand og jord har arealforholdet mellem anodeflade (det uædle, korroderende metal) og katodeflade afgørende betydning for, hvor kraftig den galvaniske korkorrosion bliver. Mest ugunstig er et stort katodeareal i forhold til et lille anodeareal.
Kobber og kobberlegeringer er mere ædle end zink, og zinken vil derfor blive udsat for galvanisk korrosion ved kontakt med kobber. På zinkoverfladerne op mod kobberlegeringen vil der ske en fældning af kobberioner, der forstærker den galvaniske korrosion. Af samme årsag bør man ikke anvende kobber eller kobberlegeringer, hvor regnvand kan løbe fra kobberoverflader og ud på zink. Regnvandet vil indeholde lidt opløst kobber, der fældes som små mikroskopiske kobberpartikler på zinkoverfladen, der herved udsættes for galvanisk korrosion
Galvanisk korrosion af forzinket stål i kontakt med indstøbt armering
Hvis varmforzinket stål kommer i kontakt med armeringsstål indstøbt i beton, og der er en elektrolyt i tilslutning til det varmforzinkede stål, kan der opstå en galvanisk korrosionscelle. Man er blevet opmærksom på dette problem inden for vejanlæg, hvor varmforzinkede pæle er kommet i kontakt med broarmering, og i staldmiljøer, hvor der er skabt kontakt for at potentialudligne bygningen.
Når almindeligt armeringsjern af kulstofstål støbes ind i beton, bliver det passiveret (ædelt), hvilket betyder, at det får samme korrosionspotentiale som rustfrit stål. Hvis staldinventaret, der normalt er varmforzinket, forbindes med den indstøbte armering, dannes der en galvanisk celle, hvor der i nogle tilfælde er set meget hurtige korrosionsforløb hos zinken.
Når zinken er korroderet væk, fortsætter angrebet på det underliggende stål, hvilket betyder, at pæle og lister efterhånden bortkorroderer. Det skyldes, at stålet i inventaret har et korrosionspotentiale, der er betydeligt mere negativt (uædelt) i væske, gødning eller fugtig strøelse end passiveret indstøbt stål. Selvom det er samme type stål, medfører de forskellige miljøer, som materialet anvendes i, at det indstøbte stål bliver katoden og det fugteksponerede stål anoden i den galvaniske celle.
Ved galvanisk korrosion spiller størrelsen på katodens (ædlere metal) og anoden (uædlere metal) en vigtig rolle. I dette tilfælde har armeringsmåtten (katoden) en stor volumen i forhold til det varmforzinkede stål, hvis anodeoverflade kun består af det/de lokale mindre områder, hvor elektrolytten har kontakt med metallet. Dette ulige størrelsesforhold bidrager yderligere til det accelererede korrosionsforløb.
Korrosionsangrebene ses f.eks. på inventardele i boksenes underdele, der kommer i kontakt med urin og gødning, eller i forbindelse med dyrenes drikkekar. Diverse faktorer afgør, hvor hurtigt korrosionsforløbet sker. Forholdet mellem tør og våd tid for de udsatte overflader, strøelsestype, dyrenes adfærd og opstaldningssystem (bås/boks/løsdrift) påvirker korrosionsforløbet. Generelt kan man sige, at strøelse med stor sugeevne normalt giver et tørrere miljø og reducerer risikoen for accelererede korrosionsforløb.
For at afbryde korrosionen skal enten kontakten mellem det varmforzinkede stål og den indstøbte armering eller kontakten mellem det varmforzinkede stål og elektrolytten afbrydes. Sidstnævnte kan f.eks. ske med konstruktionsændringer eller isolering med maling eller andet materiale, der påføres på de udsatte områder af det varmforzinkede stål.
Zinkbelægninger i kontakt med andre metaller end stål
Som det fremgår af billede 7, er zink elektrokemisk uædel i forhold til de fleste andre brugsmetaller, hvilket betyder, at zink beskytter disse mod korrosion ved offervirkning. Dette svarer til, at zinken udsættes for galvanisk korrosion. Man skal i videst muligt omfang undgå sådanne koblinger. I luft kan der opnås en god beskyttelse ved at anvende ikke ledende mellemlag af plast eller gummi.
Pakning og transport af varmforzinket materiale
Selv om belægningen på varmforzinket materiale tåler en ret hård behandling bør materialet ved levering og lagring håndteres forsvarligt/fornuftigt. Simpel forpakning og bundtning af langt materiale giver ikke bare beskyttelse mod mekaniske skader men ofte også logistikmæssige fordele. Forpakning og bundtning skal dog ske således at hvidrust undgås. Mellemlæg placeres, så materialets flader ventileres.
