Stål är vår tids mest använda material. Tyvärr har stål en stor nackdel och det är dess höga korrosionshastighet. Att skydda detaljer och konstruktioner av stål har därför ett stort värde. Det bästa korrosionsskyddet erhålls med zink. Zinkbeläggningar skyddar stål på två sätt: • Genom barriärverkan, dvs hindrar syre och fukt att tränga fram till stålytan. • Genom att ge katodiskt skydd i repor, slagmärken, klippkanter osv. Zink är en oädel metall med stor korrosionsbenägenhet. Att korrosionshastigheten ändå är låg i de flesta miljöer beror på att zinkens yta snabbt blir täckt med korrosionsprodukter, som sedan skyddar mot vidare korrosion
Korrosion i atmosfären
När ett varmförzinkat föremål lämnar zinkbadet angrips ytan genast av luftens syre och zinkoxid bildas. Processen fortskrider med hjälp av luftens vatten- och koldioxidinnehåll varvid basiska zinkkarbonater skapas. Dessa ger ett tätt skikt med utmärkt vidhäftning. Då karbonaterna dessutom har mycket låg löslighet i vatten utgör de ett gott skydd för den förzinkade ytan. Men luften innehåller också svaveldioxider, som omvandlar det basiska zinkkarbonatet till mer lättlösligt zinksulfit och zinksulfat. Luftens halt av svaveldioxid har dock minskat kraftigt de senaste åren, och därmed också zinkens korrosion. Atmosfärens halt av svaveldioxid påverkar således korrosionshastigheten. I industriatmosfär är därför korrosionen högre än i stads- och landsbygdsmiljö. Av betydelse i alla miljöer är exponeringsvinkeln. Korrosionen är högre på en horisontell yta än på en vertikal yta. Ytor som befinner sig i lä korroderar mindre än oskyddade ytor.
Zinkskikt som exponeras några månader i atmosfären får en matt, ljusgrå kulör (bild 1). I havsmiljö påverkas zinkens korrosion av luftens salthalt. I den marina luften finns dock små halter av magnesiumsalter med god passiverande verkan. Korrosionen är därför inte så stor som man befarat. Salthalten avtar också snabbt in mot land.
Flera faktorer inverkar
Zinkens korrosion påverkas alltså av många faktorer. Det går därför inte att ge en allmängiltig formel för korrosionshastigheten. Zinkbeläggningar har emellertid använts under lång tid och under de mest skiftande förhållanden för att skydda stål mot rost. Kunskapen om zinkens korrosion och korrosionshastighet i olika miljöer är därför god. Vi har idag exempel på zinkbeläggningar som exponerats i över hundra år.
Rödbrun missfärgning
Kiseltätade stål som har stor andel järn-zinkfas i zinkskiktet kan efter en tids exponering få en rödbrun färgton som djupnar med tiden. Järn-zinkfasen korroderar, varvid järn frigörs, som tillsammans med fukt från luften eller regnvatten bildar rost. Rosten har stor färggivande förmåga och även små mängder kan ge avsevärda missfärgningar (bild 2) . En kraftig missfärgning kan lätt uppfattas som att rostskyddet är nedsatt eller helt slut. Detta är dock sällan fallet. Järnzink-legeringen skyddar stålet bättre än ren zink – upp till 30 % förbättring har noterats. Den missfärgade ytan kan, om så krävs av utseendeskäl, med fördel målas. En missfärgad lyktstolpe som exponerats i 30 år hade vid undersökning ca 70 mikrometer zinkskikt kvar – tillräckligt för ytterligare ca 50 års livslängd.

Bild 1. Exponerad yta av en zinkbeläggning med ett yttre skikt av ren zink. Den blanka ytan försvinner och ersätts av grå korrosionsprodukter – ibland kallat zinkpatina.

Bild 2. Rödbrun missfärgning.
Korrosion i vätskor
Liksom vid korrosion i luft överdras zinkytan vid nedsänkning i en vätska i allmänhet med ett skyddande skikt av korrosionsprodukter. Vätskor kan vara sura eller alkaliska och innehålla lösta eller fasta aggressiva ämnen. Vätskans strömningshastighet och temperatur har också stor betydelse. Tillsammans medför dessa faktorer att skyddsskiktet kan få en högst varierande sammansättning eller t.o.m. inte bildas alls. Den elektrokemiska korrosionen, som i luft spelar en underordnad roll, har stor betydelse i vätskor. Beroende på vätskans elektriska ledningsförmåga sker den elektrokemiska korrosionen, och därmed också zinkskiktets skyddsverkan, över större eller mindre områden. Största betydelse har vätskans pH-värde. Zinkens korrosionshastighet är normalt relativt låg och stabil i pH-området 5,5-12,5 vid temperaturer mellan 0 och 20 °C. Hårda vatten, som innehåller kalk och magnesium, är föga aggressiva. Dessa ämnen bildar tillsammans med kolsyra svårlösliga karbonater på zinkytan och ger stabila skyddsskikt, som hindrar vidare korrosion.
Mjuka vatten angriper ofta zink eftersom salter saknas och skyddsskiktet inte kan bildas. I mindre vanliga fall kan det också ske en polaritetsväxling mellan zink och stål så att stål blir anod (lösningspol) i elementet. Risk för punktkorrosion finns i sådana fall. Polaritets växlingen motverkas av kolsyra, sulfater och klorider och sker därför inte i t ex havsvatten, men kan däremot förekomma i mycket rena vatten. Aggressiva mjuka vatten finns i vissa vattendrag och sjöar i Finland, Norge och Sverige.
Har vattnet högre strömningshastighet än 0,5 m/s hindras bildningen av skyddsskikt på zinkytan och korrosionen blir snabbare. I vatten har temperaturen stor betydelse för korrosionshastigheten. Över ca 55 °C får de skiktbildande korrosionsprodukterna en grovkornig struktur och förlorar vidhäftningen till zinkytan. De faller lätt av och blottlägger ny, frisk zink för fortsatt angrepp. Korrosionshastigheten når ett maximum vid ca 70 °C, för att sedan sjunka så att den vid 100 °C är av samma storleksordning som vid 50 °C. Som framgår är korrosionsförloppet i vatten mycket komplext och allmängiltiga regler är svåra att ge. Praktiska erfarenheter finns och bild 3 ger riktvärden för några olika typer av vatten.
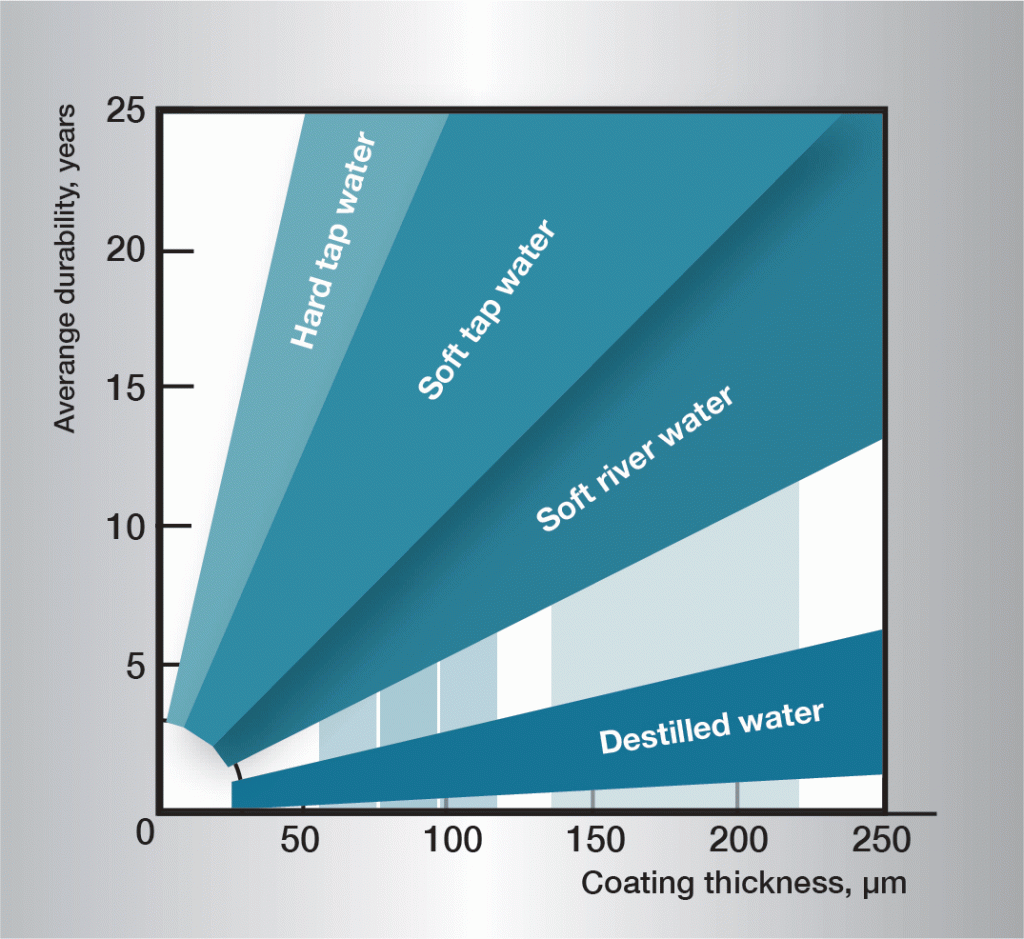
Bild 3. Medellivslängd för olika tjocka zinkskikt i skilda vatten.
Korrosion i jord
Korrosionsförhållandena i jord är mycket komplicerade och variationerna kan vara mycket stora mellan olika platser, även helt nära intill varandra. Svenska jordar är i allmänhet inte särskilt aggressiva, se bild 6. Medelavfrätningen för zink brukar anges till 5 µm per år. Svårt aggressiva jordar är sällsynta. I Norr- och Västerbotten finns svavelhaltiga jordar där zinkkorrosionen är mycket hög. En metod att bestämma jordens korrosivitet är att mäta dess resistivitet (bild 7). Kan jordresistiviteten inte bestämmas kan tumreglerna i bild 6 ge en viss vägledning. Vid all exponering av metaller i jord är det oftast bäst att ta hjälp av experter inom området.

Vitrost
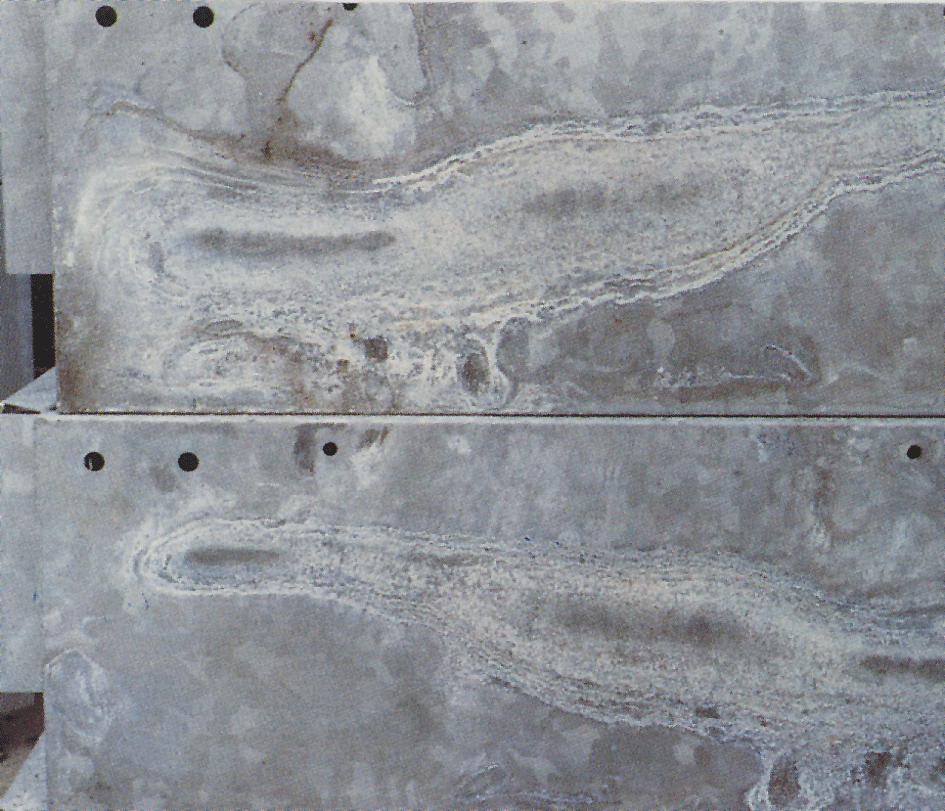
Ibland uppträder en vit, mjölig och voluminös beläggning kallad vitrost eller vitblemma på förzinkade ytor (bild 4). Vitrost uppträder om förzinkat gods utsätts för kondens eller regnvatten som blir liggande kvar på godsytan. Detta kan inträffa där spalter bildas, t ex mellan hoplagda godsytor eller mellan tätt packade plåtar. Godsytor, som har god luftväxling och byggt upp ett normalt skyddsskikt av korrosionsprodukter, angrips sällan. Angreppet upphör således när fri tillgång till luft finns. Kvarvarande vitrost nöts så småningom bort av väder och vind. Zinkytan får åter ett för varmförzinkning normalt utseende.
Då vitrost har mycket stor volym, ca 500 gånger större än den zink från vilken den bildas, kan ett angrepp förefalla allvarligt. Oftast har emellertid angrepp av vitblemma liten eller ingen betydelse för korrosionsskyddets livslängd. Vid mycket tunna beläggningar, som på elförzinkade föremål, kan dock ett kraftigt angrepp vara skadligt.
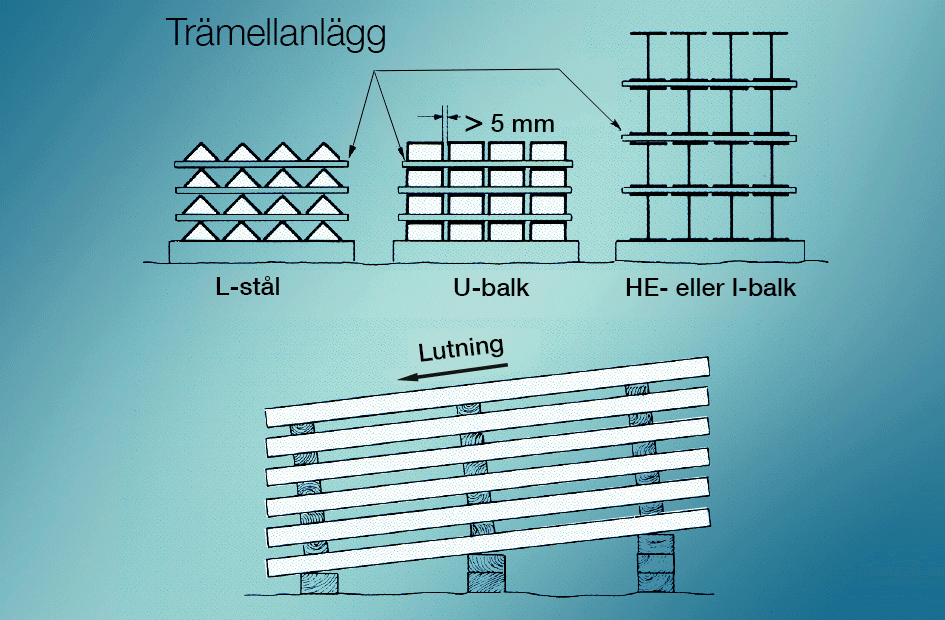
Vitrost undviks bäst genom att nyförzinkade ytor hindras att komma i kontakt med kondens eller regnvatten under lagring och transport. Genom att lagra godset under tak några dagar, eller att lägga upp det så att vattnet rinner av och det finns luftväxling från alla sidor, undviks problemet, se bild 5. Redan bildad vitrost kan avlägsnas med måttfull mekanisk eller kemisk behandling. I varmförzinkningsstandarden godtas ej vitrost som orsak till reklamation.
Galvanisk korrosion

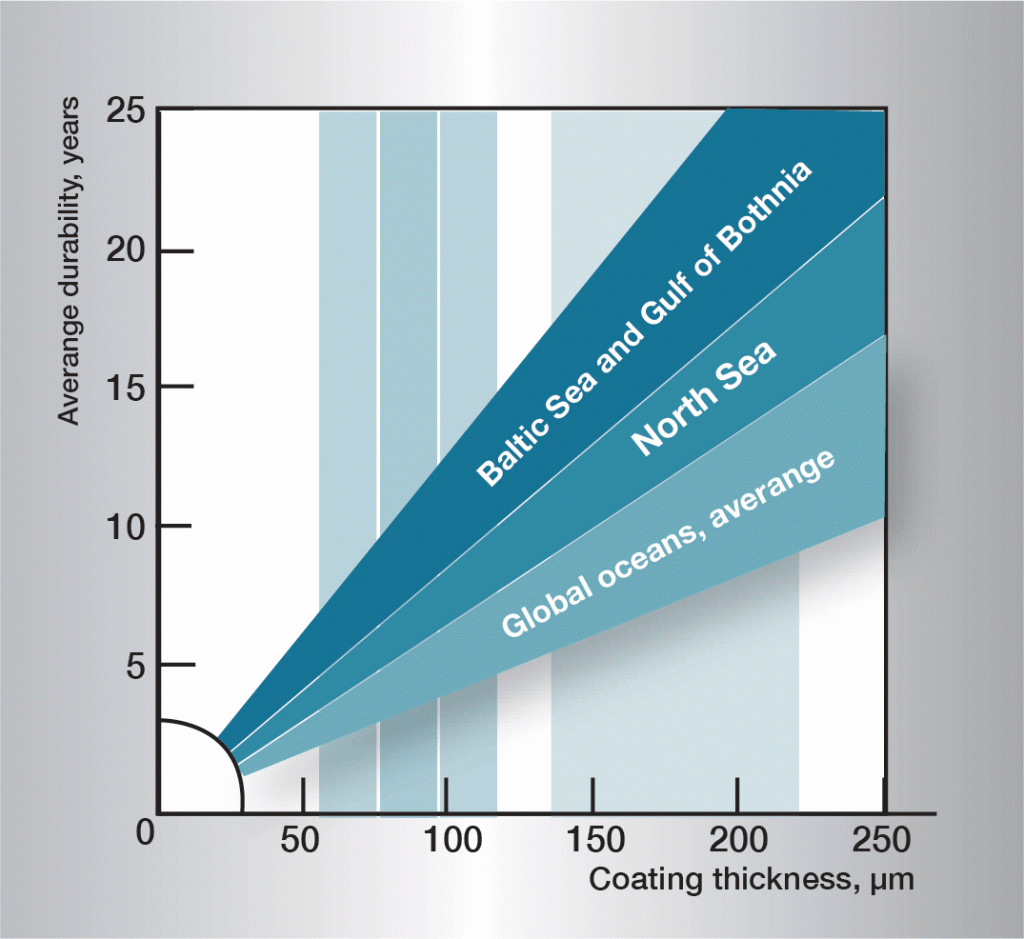
Om två olika metaller, helt eller delvis omgivna av en elektrolyt, kopplas samman uppstår en galvanisk cell. Vilken av metallerna som blir anod eller katod bestäms av deras elektrodpotential i ifrågavarande elektrolyt. I havsvatten, som motsvarar de flesta praktiska förhållanden, intar några olika metaller och legeringar platser enligt bild 7 i den galvaniska spänningsserien.
Om stål kopplas ihop med koppar eller mässing blir stålet anod och korroderar. Kopplas däremot stål ihop med zink, kadmium eller magnesium blir stålet katod och skyddas mot korrosion medan anodmetallen förbrukas.
Galvanisk korrosion kallas också bimetallkorrosion och används för att skydda konstruktioner i vatten mot korrosion under benämningen katodiskt skydd.
Zinkbeläggningars katodiska skydd
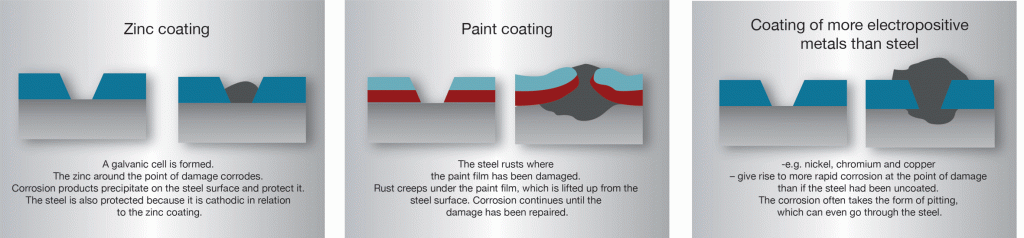
I varmförzinkat stål står zink och stål i god elektrisk kontakt med varandra. Skadas zinkbeläggningen uppstår i närvaro av fukt (elektrolyt) en galvanisk cell. I cellen blir zinken anod (upplösningspol) och korroderar medan frilagda stålet blir katod och skyddas. I initialskedet kan man se en svag rostbildning på den frilagda stålytan. Allt eftersom zinken korroderar fälls svårlösliga zinkföreningar ut på skadan och skyddar stålet mot fortsatt angrepp. Detta kallas ofta ”självläkning”, men det är en oegentlig benämning eftersom zinkskiktet inte återställs. Tack vare det katodiska skydd som zinken ger kan inte rost krypa in under beläggningen vid skador på samma sätt som under färgbeläggning eller under beläggningar av ädlare metaller (bild 8). Zinkbeläggningar på stål är således unika i det avseendet att en måttligt stor skada i beläggningen inte medför en katastrofal försämring av korrosionsskyddet.
Galvanisk korrosion hos förzinkat stål i kontakt med ingjuten armering
Om varmförzinkat stål kommer i kontakt med armeringsstål ingjutet i betong, och en elektrolyt finns närvarande i anslutning till det varmförzinkade stålet, kan en galvanisk korrosionscell bildas. Detta problem har uppmärksammats både i vägmiljöer, där varmförzinkade stolpar kommit i kontakt med broarmering, och i djurstallar, där kontakt skapats för att potentialutjämna byggnaden.
Då vanligt armeringsjärn av kolstål gjuts in i betong blir det passiverat (ädelt), vilket innebär att det får en korrosionspotential motsvarande rostfritt stål. Om stallinredningen, som vanligtvis är varmförzinkad, förbinds med den ingjutna armeringen ger detta upphov till en galvanisk cell, där mycket snabba korrosionsförlopp hos zinken har noterats i vissa fall. När zinken korroderat bort fortsätter angreppet på det underliggande stålet, vilket medför att stolpar och lister med tiden kan korrodera sönder.
Anledningen är att stålet i inredningen har en korrosionspotential som är betydligt mer negativ (oädel) i vätska, gödsel eller fuktig ströbädd, jämfört med korrosionspotentialen för ingjutet stål, som passiverats. Trots att det handlar om samma typ av stål medför de olika miljöerna som materialet används i, att det ingjutna stålet blir katod och det fuktexponerade anod i den galvaniska cellen. Vid galvanisk korrosion spelar också storleken på katoden (ädlare metall) och anoden (oädlare metall) en viktig roll. I det här fallet har armeringsmattan katoden) en stor volym i förhållande till det varmförzinkade stålet, vars anodyta endast består av det/de lokala mindre områden där elektrolyten står i kontakt med metallen. Detta ogynnsamma storleksförhållande bidrar ytterligare till det accelererade korrosionsförloppet. Korrosionsangreppen påträffas t ex på inredningsdetaljer i djurboxarnas nedre delar, som utsätts för urin och gödsel, eller i anslutning till djurens vattenkoppar.
Hur snabbt korrosionsförloppet går beror på en rad olika faktorer. Relationen mellan torr- och våttid för de utsatta ytorna, typ av ströbädd, djurens beteende, uppstallningssystem (spilta/box/lösdrift) påverkar korrosionsförloppet. Generellt kan sägas att bäddmaterial med stor uppsugningsförmåga vanligtvis ger en torrare miljö och minskar risken för accelererade korrosionsförlopp. I vägmiljöer sker den galvaniska korrosionen i stolparnas nederkant, där elektrolyt i form av regnvatten, snöslask och vägsalt förekommer. För att avbryta korrosionen måste antingen kontakten mellan det varmförzinkade stålet och den ingjutna armeringen, eller kontakten mellan det varmförzinkade stålet och elektrolyten, brytas. Det sistnämnda kan t ex ske genom konstruktionsförändringar eller isolering med färg eller annat material, som läggs på det varmförzinkade stålet i de utsatta områdena.
Zinkskikt i kontant med andra metaller än stål
Som framgår av bild 7 är zink oädlare än de flesta bruksmetaller, vilket betyder att zink skyddar dessa mot korrosion. I princip bör man dock undvika sådana sammankopplingar och ett bra sätt är att använda icke ledande mellanlägg av plast eller gummi. I luft eller någorlunda torra miljöer kan ofta aluminium och rostfria stål direkt sammanbindas med förzinkat material utan att märkbar korrosion uppstår. Försiktighet bör dock iakttas så att katodytan inte blir för stor i förhållande till anodytan. I vatten skall alltid isolerande mellanlägg användas. Koppar och kopparlegeringar är mer elektriskt aktiva och dessutom förekommer det att kopparjoner löses ut, vilket ger ett icke försumbart angrepp. ”Färgade” metaller skall därför aldrig tillåtas stå i kontakt med förzinkat stål utan mellanlägg.
Packning och transport av varmförzinkat gods
Även om beläggningen på varmförzinkat gods tål en ganska omild behandling bör godset vid leverans och lagring hanteras med förnuft. Enklare förpackningar och buntning av långt gods ger inte bara skydd mot mekaniska skador utan ofta också transporttekniska fördelar. Förpackning och buntning skall dock ske så att vitrost undviks. Mellanlägg bör utformas så att godset packas luftigt.
